南京工大纪晓俊等:合成生物学优化酵母代谢过程中的碳保存和碳固定
随着化石资源的不断开发和利用,由此带来的CO2高排放引发的气候变化备受人们关注,亟须寻找可持续性的解决方案。借助于微生物的代谢功能,利用合成生物学的手段对其进行优化改造,实现化学品的生物制造是一种优异的解决方案。
酵母作为合成生物学研究中一类重要的底盘微生物,已经被成功应用于多种产品的生物制造。对酵母的天然碳代谢途径进行改造以实现更大程度的碳保存,并通过构建人工途径将无机碳转化为有机碳从而实现碳固定是进一步减少碳排放的有效途径。
【SynBioCon】获悉,近日,南京工业大学纪晓俊教授团队在《化工进展》期刊上发布《合成生物学优化酵母代谢过程中的碳保存和碳固定》一文。
本章综述了近年来利用合成生物学手段在酵母中构建碳保存和碳固定系统的研究进展,重点介绍了以酿酒酵母、解脂耶氏酵母和毕赤酵母为代表的酵母类微生物的研究概况,包括避免非必要脱羧反应减少碳损耗和强化天然羧化反应促进碳保存,以及构建基于二氧化碳回用和代谢利用的碳固定系统,在此基础上展望了通过构建低碳酵母细胞工厂进行生物制造的未来发展方向。
人类对化石资源的大量使用正引起温室气体CO2排放增加,由此引发的气候变化问题已经引起了全球关注,亟须寻找替代方案实现碳中性,甚至碳负性生产。一种有前景的策略是在工业生产过程中减少CO2排放甚至直接从大气中捕集CO2并利用。近年来,合成生物学的发展使得微生物可以利用廉价的底物,如木质纤维素生产化学品,这一定程度上从原料端降低了化石资源的使用;进一步通过优化微生物代谢途径可增强其碳保存能力,减少CO2释放并提高化学品的得率,甚至可以利用自养微生物,通过天然的碳固定途径吸收CO2用于生物制造。然而,自养微生物虽然具备捕获CO2积累生物量并合成化学品的能力,但其固碳效率低、生长缓慢,同时合成生物学改造工具不成熟,限制了其在工业生产上的应用。
酵母是一类优秀的底盘微生物,其具有较强的鲁棒性,对于酸性等条件的耐受性更高,十分有益于工业生物制造。在工业生产中已被用于萜烯、脂肪酸等化合物的生物制造,如酿酒酵母生产β-法尼烯、解脂耶氏酵母生产二十碳五烯酸等。由于代谢过程的复杂性,酵母类微生物在通过代谢合成化学品的过程中不可避免地会释放CO2,CO2的释放主要发生在糖酵解(EMP)、磷酸戊糖循环(HMP)和三羧酸循环(TCA)等途径中,这些途径的正常运转可为细胞生长提供还原力和能量,并维持体内的氧化还原平衡。随着对酵母代谢过程的不断理解,通过对代谢途径进行重编程可极大促进对底物的碳保存以及对CO2的固定能力。
本文综述了近年来利用合成生物学手段在酵母中构建碳保存和碳固定系统的研究进展,重点介绍了以酿酒酵母、解脂耶氏酵母和毕赤酵母为代表的酵母类微生物的研究概况,包括避免非必要脱羧反应减少碳损耗和强化天然羧化反应促进碳保存,以及构建基于二氧化碳回用和代谢利用的碳固定系统,在此基础上展望了通过构建低碳酵母细胞工厂进行生物制造的未来发展方向。
01
酵母中碳保存系统构建
酵母代谢过程中,随着生物量的积累与代谢产物的合成,会伴随发生众多的脱羧生化反应,这些脱羧生化反应会产生CO2,从而降低了最终的碳得率。对酵母代谢途径的重编程可以避免这种情况的发生;同时酵母中存在天然的羧化生化反应,对其进行强化可以进一步促进碳保存(表1)。图1所示为酵母利用非氧化糖酵解途径和天然羧化生化反应促进碳保存。
表1
合成生物学优化酵母代谢过程中的碳保存策略
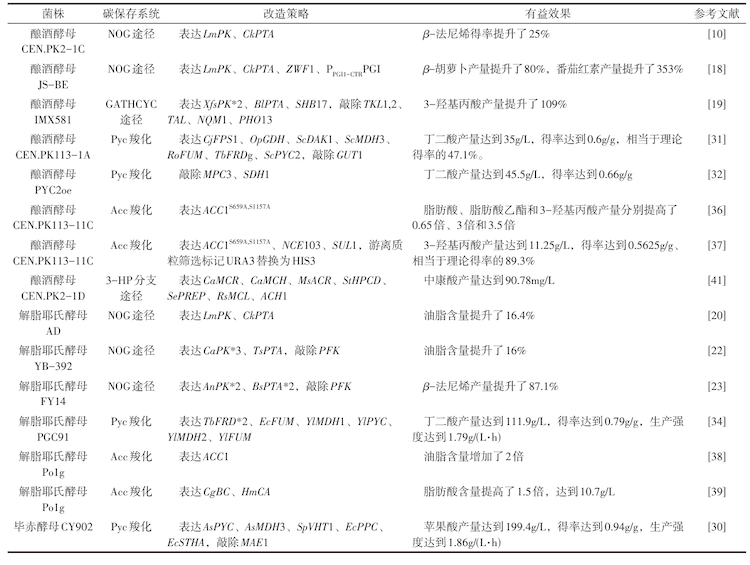
图1
酵母中利用非氧化糖酵解途径和天然羧化反应促进碳保存
(绿色线条为非氧化糖酵解途径;红色线条为天然羧化反应;蓝色线条为脱羧反应)F6P—果糖-6-磷酸;E4P—赤藓糖-4-磷酸;Acp—乙酰磷酸;Ac-CoA—乙酰辅酶A;AC-derived products—乙酰辅酶A衍生产物;G3P—甘油酸-3-磷酸;Pyr—丙酮酸;OAA—草酰乙酸;Mal—苹果酸;Fum—富马酸;Suc—丁二酸;Succ—丁二酰辅酶A;α-KG—α-酮戊二酸;Icit—异柠檬酸;Cit—柠檬酸;Mal-CoA—丙二酰辅酶A;MC-derived products—丙二酰辅酶衍生产物;Ca—碳酸酐酶;Pk—磷酸酮解酶;Pta—磷酸转乙酰酶;Pyc—丙酮酸羧化酶;Pycm—丙酮酸羧化酶锚定于线粒体;Acc—乙酰辅酶A羧化酶;Glu—葡萄糖;Acyl-CoA—酰基辅酶A
1.1
避免非必要脱羧反应减少碳损耗
糖酵解作为酵母中最基本的代谢途径,其将糖转化为丙酮酸并产生还原型辅酶Ⅰ(NADH)和腺嘌呤核苷三磷酸(ATP),为酵母生长提供还原力和能量;丙酮酸则进一步通过脱羧反应生成乙酰辅酶A,作为必需前体供给细胞生长。同时,乙酰辅酶A也是萜烯类、脂肪酸等化合物的合成前体。然而,丙酮酸经脱羧反应生成乙酰辅酶A是一个碳损耗过程,导致糖来源的乙酰辅酶A理论碳得率仅为66.7%,这增加了乙酰辅酶A衍生产物合成的底物成本。Bogorad等在大肠杆菌中设计了一种称为非氧化糖酵解(NOG)的乙酰辅酶A合成途径,该途径与糖酵解途径相比,克服了碳损耗过程,允许C6、C5和C3磷酸盐生成化学计量的乙酰辅酶A。其中,磷酸酮解酶(Pk)催化果糖-6-磷酸(F6P)或木酮糖-5-磷酸(Xu5P)裂解为赤藓糖-4-磷酸(E4P)或甘油醛-3-磷酸(GAP)和乙酰磷酸(Acp)是NOG途径的关键(图1)。经过碳重排后,不可逆地将一分子果糖-6-磷酸转化为3分子乙酰磷酸,后者则在磷酸转乙酰酶(Pta)催化下转化为乙酰辅酶A。目前,NOG途径已被广泛应用于酵母中乙酰辅酶A衍生物的低碳高转化率合成。
酿酒酵母具有清晰的遗传背景和成熟的基因操作工具,是合成生物学研究中的模式菌株之一。Meadows等通过在酿酒酵母中异源表达肠膜明串珠菌(Leuconostoc mesenteroides)来源的木酮糖-5-磷酸特异性磷酸酮醇酶(Pk)和克卢维尔梭菌(Clostridium kluyveri)来源的磷酸转乙酰酶(Pta)编码基因构建了NOG途径,避免了非必要的脱羧反应,使得工程菌株减少了CO2损耗,并且降低了对ATP和O2的需求,合成目标产物β-法尼烯的得率提高了25%。Fan等用乳糖诱导型启动子GAL1/10驱动NOG途径编码基因表达生成乙酰辅酶A,并将糖酵解途径中磷酸葡萄糖异构酶(Pgi)编码基因启动子替换为铜离子抑制型启动子CTR1,实现了对糖酵解途径的选择性调控,进一步过表达磷酸戊糖途径限速步骤葡葡糖-6-磷酸脱氢酶(Zwf1)编码基因,增强还原型辅酶Ⅱ(NADPH)和NOG途径前体木酮糖-5-磷酸的供应;通过上述3步操作,成功实现了对非天然NOG途径和天然糖酵解途径以及磷酸戊糖途径通量的选择性调控,最终将目标乙酰辅酶A衍生产物β-胡萝卜素和番茄红素产量分别提高了80%和353%。NOG途径能够避免碳损耗,但是该途径中转醛酶(Tkl)和转酮酶(Tal)的催化反应是可逆的,是该途径的限速酶。Hellgren等采用COPASI算法评估了酿酒酵母中NOG途径的瓶颈,发现甘油醛-3-磷酸可用性的限制将导致转醛酶(Tkl)底物缺乏从而积累另一底物景天庚酮糖-7-磷酸(S7P)。故将包含景天庚酮糖-7-磷酸活性的磷酸酮解酶(Pk)引入算法中,并基于此构建了一条替代糖酵解高碳得率循环(glycolysis alternative high carbon yield cycle, GATHCYC)途径。该GATHCYC途径不需要转醛酶(Tkl)和转酮酶(Tal)的参与,降低了人工途径的复杂性,该作者进一步将GATHCYC途径引入酿酒酵母工程菌株后,乙酰辅酶A衍生产物3-羟基丙酸产量提升了109%。
解脂耶氏酵母是一种重要的产油酵母,具有丰富的胞质NADPH和乙酰辅酶A含量,常被用作脂肪酸、萜烯类等化合物合成的底盘微生物。Qiao等在解脂耶氏酵母中表达肠膜明串珠菌来源的磷酸酮解酶(Pk)和克卢维尔梭菌来源的磷酸转乙酰酶(Pta)编码基因构建了NOG途径,基于该途径合成NADPH和乙酰辅酶A,最终菌株生物量和乙酰辅酶A衍生产物油脂含量分别提高了41%和16.4%。更重要的是,NOG途径的引入显著降低了CO2的释放。解脂耶氏酵母中,磷酸戊糖途径(HMP)是NADPH的主要来源,当敲除磷酸果糖激酶(Pfk)编码基因阻断糖酵解途径时,高通量HMP产生的过量NADPH会导致体内辅因子失衡,从而影响菌株的正常生长。NOG途径的引入可以连接HMP和NADPH依赖的产物合成途径从而平衡解脂耶氏酵母体内NADPH,并补充由EMP中断造成的乙酰辅酶A供给缺乏。Kamineni等首先筛选了不同微生物来源的磷酸酮解酶(Pk)和磷酸转乙酰酶(Pta),发现枯草芽孢杆菌(Bacillus subtilis)和解糖热厌氧杆菌(Thermoanaerobacterium saccharolyticum)来源的磷酸转乙酰酶(Pta),丙酮丁醇梭菌(Clostridium acetobutylicum)来源的磷酸酮解酶(Pk)在解脂耶氏酵母中具有高活性。经过对上述编码基因密码子优化并多拷贝编码基因提高酶活性,磷酸果糖激酶(Pfk)缺失的解脂耶氏酵母菌株恢复了生长,降低了CO2释放的同时,乙酰辅酶A衍生产物油脂含量提升了16%。Bi等在一株高产β-法尼烯的解脂耶氏酵母菌株中采取了相同的策略,在磷酸果糖激酶(Pfk)缺失菌株中异源表达双拷贝构巢曲霉(Aspergillus nidulans)来源的磷酸酮解酶(Pk)和枯草芽孢杆菌来源的磷酸转乙酰酶(Pta)编码基因构建NOG途径后,降低了CO2释放的同时,乙酰辅酶A衍生产物β-法尼烯产量提高了87.1%。
微生物中有一类化合物的合成需要丙二酰辅酶A的参与(如上述油脂类、黄酮聚酮类天然产物),而丙二酰辅酶A通常由乙酰辅酶A经过羧化反应形成,因此由糖到丙二酰辅酶A的代谢步骤需要经过丙酮酸脱羧和乙酰辅酶A羧化这一过程。该过程动力学缓慢、需要消耗ATP且受到严格的代谢调控,限制了丙二酰辅酶A的生成并造成了CO2的损耗。Li等设计了一种以丙酮酸为前体的非天然丙二酰辅酶A生成途径,该途径先利用转氨酶催化丙酮酸生成3-氧代丙酸,随后进一步被丙二酰辅酶A还原酶(Mcr)还原为丙二酰辅酶A。经验证发现,该途径催化速率较天然途径高100倍以上,且与天然途径相比,CO2排放量显著降低。在大肠杆菌(Escherichia coli)中整合该途径后,包括短链脂肪酸辛酸、间苯三酚、黄酮醇在内的丙二酰辅酶A衍生产物产量均有所提高。同时该途径也被拓展应用到褐黄孢链霉菌(Streptomyces gilvosporeus)和多刺甘蔗多孢菌(Saccharopolyspora spinosa)中,并实现了功能性表达。尤为重要的是,这一非天然丙二酰辅酶A生成途径潜在的拓展至酵母中的可能性,为丙二酰辅酶A衍生产物在酵母中低碳生物制造提供了强有力的支持。
1.2
强化天然羧化反应促进碳保存
基于羧化反应的CO2固定是自然界中最常见的固碳方式。酵母体内也存在天然的羧化反应,如丙酮酸羧化酶(Pyc)以丙酮酸为前体生成草酰乙酸,乙酰辅酶A羧化酶(Acc)催化乙酰辅酶A固碳生成丙二酰辅酶A,这两者均固定HCO3-形式的碳。在酵母中,丙酮酸经羧化生成草酰乙酸是三羧酸(TCA)循环的主要补充反应,也可作为天冬氨酸、天冬酰胺、蛋氨酸等氨基酸的合成前体。同时,该催化过程是还原TCA循环第一步,并已被用于苹果酸、丁二酸等大宗化学品的生产。Xi等在毕赤酵母中表达不同来源的丙酮酸羧化酶(Pyc)和苹果酸脱氢酶(Mdh)编码基因构建还原TCA循环以筛选最佳的苹果酸生产菌株,发现表达米曲霉菌(Aspergillus oryzae)来源的丙酮酸羧化酶(Pyc)和苹果酸脱氢酶(Mdh3)编码基因的菌株苹果酸产量最高。但是,在发酵过程中发现存在丙酮酸积累情况,因此进一步敲除苹果酸酶(Mae1)、异源表达大肠杆菌来源的磷酸烯醇丙酮酸羧化酶(Ppc)以及裂殖酵母(Schizosaccharomyces pombe)来源的生物素输入蛋白(Vht1)编码基因以强化丙酮酸的利用,同时异源表达大肠杆菌来源的可溶性吡啶核苷酸转氢酶(SthA)编码基因将NADPH转化为NADH,为苹果酸脱氢酶(Mdh3)提供辅因子,经过上述操作,发现丙酮酸的积累显著降低。在补充CaCO3条件下,工程菌株在生物反应器中合成了199.4g/L苹果酸,得率和生产强度分别达到0.94g/g和1.86g/(L·h)。
基于还原TCA循环从葡萄糖生产丁二酸时,需要氧化TCA循环释放CO2以确保体内的氧化还原平衡,这限制了CO2的固定能力。使用比葡萄糖还原力更强的底物,如甘油,可避免这一限制,并通过还原TCA循环将底物完全转化为丙酮酸衍生产物丁二酸。为达到这一目标,Malubhoy等首先在酿酒酵母菌株中过表达内源丙酮酸羧化酶(Pyc2)、苹果酸脱氢酶(Mdh3)、米根霉(Rhizopus oryzae)来源的富马酸酶(Fum)以及布鲁氏锥虫(Trypanosoma brucei)来源的富马酸还原酶(Frd)编码基因构建了还原TCA循环途径合成丁二酸。该途径中苹果酸脱氢酶(Mdh3)和富马酸还原酶(Frd)催化过程均需要辅因子NADH,因此敲除甘油激酶(Gut1)编码基因阻断了内源FAD+依赖性甘油途径,并过表达产朊假丝酵母(Candida jadinii)来源的甘油转运蛋白(Fps1)、汉逊酵母(Ogataea parapolymorpha)来源的NAD+依赖型甘油脱氢酶(Gdh)和内源二羟基丙酮激酶(Dak1)编码基因重构甘油利用途径提供胞质NADH。最终丙酮酸衍生产物丁二酸产量达到35g/L,得率为0.6g/g,达到理论得率的47.1%。这表明工程菌株仅实现了CO2的部分固定,但仍有大量的碳通过氧化TCA循环释放。为此,Rendulić等进一步敲除了线粒体丙酮酸载体(Mpc3)编码基因降低线粒体对胞质丙酮酸的摄取,同时敲除丁二酸脱氢酶1(Sdh1)编码基因阻断氧化TCA循环下调氧化TCA循环的通量,工程菌株丙酮酸衍生产物丁二酸产量达到45.5g/L,得率提升到0.66g/g。在酵母中,不同的细胞器存在特定的代谢途径并承担不同的代谢功能,如TCA循环存在于线粒体中为氧化磷酸化提供还原力NADH和FADH2。Cui等在解脂耶氏酵母中将还原TCA循环途径酶,内源丙酮酸羧化酶(Pyc)、苹果酸脱氢酶(Mdh2)、富马酸酶(Fum)以及布鲁氏锥虫来源的富马酸还原酶(Frd)锚定于线粒体中,耦合氧化TCA循环,实现CO2的固定和NADH的循环再生。最终菌株在中试发酵条件下合成了111.9g/L的丁二酸,得率和生产强度分别达到0.79g/g和1.79g/(L·h)。
乙酰辅酶A羧化酶(Acc)催化乙酰辅酶A羧化生成丙二酰辅酶A,是脂肪酸从头合成的第一步,丙二酰辅酶A后续则作为脂肪酸延伸的主要单元。在酿酒酵母中,乙酰辅酶A羧化酶活性由多种调控策略调节,其中,Snf1作为一种全局调控因子,可以磷酸化乙酰辅酶A羧化酶的丝氨酸和苏氨酸残基,以调节其在翻译水平上的活性。Shi等根据Snf1的磷酸化识别序列(Hyd-X-Arg-XX-Ser-XXX-Hyd)推测了酿酒酵母中乙酰辅酶A羧化酶潜在的磷酸化位点,并将磷酸化位点的Ser突变为Ala,以释放其活性。酿酒酵母中过表达乙酰辅酶A羧化酶突变体(ACCS659A,S1157A)编码基因后,乙酰辅酶A羧化酶活性提高了3倍,并使丙二烯辅酶A衍生产物脂肪酸、脂肪酸乙酯和3-羟基丙酸产量分别提高了0.65倍、3倍和3.5倍。在另一项研究中,Qin等使用Yeast8代谢网络模型模拟发现酿酒酵母中丙二酰辅酶A衍生产物3-羟基丙酸的生产主要受到HCO3-可用性的限制。在酿酒酵母中表达乙酰辅酶A羧化酶突变体(AccS659A,S1157A)编码基因强化其对乙酰辅酶A羧化的基础上,又采取多种策略增强HCO3-的可用性。其中,内源碳酸酐酶编码基因NCE103表达可催化CO2水化为HCO3-,碳酸氢盐摄入转运蛋白(Sul1)编码基因表达可增强对HCO3-的摄取,这提高了体内HCO3-含量。嘧啶环合成时需要消耗HCO3-,同乙酰辅酶A羧化酶存在底物竞争,URA3催化的反应是嘧啶环合成的关键步骤,因此将游离质粒筛选标记URA3替换为HIS3以降低HCO3-的消耗。上述策略的实施使得最终菌株在以20g/L葡萄糖和7.5g/L CaCO3为共底物时合成了11.25g/L 3-羟基丙酸,得率为0.5625g/g,相当于理论得率的89.3%。
在解脂耶氏酵母中,乙酰辅酶A羧化酶(Acc)也常被用做脂肪酸类化合物合成改造的靶点。Tai等在解脂耶氏酵母中强化内源乙酰辅酶A羧化酶的表达后,丙二酰辅酶A衍生产物油脂含量增加了2倍,达到细胞干重的17.9%。You等为减少解脂耶氏酵母脂肪酸合成过程中的碳损耗,异源表达了谷氨酸棒杆菌(Corynebacterium glutamicum)来源的生物素羧化酶(Bc)编码基因,以增强乙酰辅酶A羧化酶的羧化,同时异源表达海洋氢氧化弧菌(Hydrogenovibrio marinus)来源的碳酸酐酶(Ca)编码基因催化CO2的水化。这些步骤将细胞生长过程中释放的CO2回用,并引导至脂肪酸合成,最终菌株丙二酰辅酶A衍生产物脂肪酸含量提高了1.5倍,达到10.7g/L。
乙酰辅酶A羧化酶是3-羟基丙酸(3-HP)双循环和3-羟基丙酸/4-羟基丁酸(HP/HB)循环途径共有的固碳酶。3-HP双循环途径是在光合绿色非硫细菌中被发现的,在CO2固定途径中拥有最复杂的酶促反应,但根据氧敏感性、ATP需求、热力学、酶动力学和碳的固定形式等综合考虑,其是好氧条件下最适合的CO2固定途径。Xu等以3-HP双循环途径中间体中康酸为指示物,评估了该途径部分分支在酿酒酵母中的构建情况。首先,表达了7步酶促反应的编码基因打通了以乙酰辅酶A衍生物丙二酰辅酶A为前体的中康酸合成途径,实现了3-HP分支途径的构建。后为进一步提高途径的通量,优化了苹果酸辅酶A还原酶(Mcr)两个结构域编码基因的表达,并且多拷贝苹果酸辅酶A还原酶和丙酰辅酶A合成酶(Acr)编码基因增强了3-HP分支途径合成效率。最终菌株以葡萄糖为底物合成了90.78mg/L中康酸,为3-HP双循环途径在酿酒酵母中的功能性表达奠定了基础。
02
酵母中碳固定系统构建
低碳酵母细胞工厂构建的目标是回用生产过程中释放的CO2并重新引导至产物合成,进一步则是直接以CO2为底物生成目标产物。这需要在酵母中整合碳固定途径,实现CO2的回用,甚至将异养的酵母转化为自养的酵母(表2)。目前,在酵母中实现功能性表达的碳固定途径有两种,卡尔文(CBB)循环和还原性甘氨酸(rGly)途径。图2所示为酵母中人工固碳途径的构建。
表2
合成生物学优化酵母代谢过程中的碳固定策略
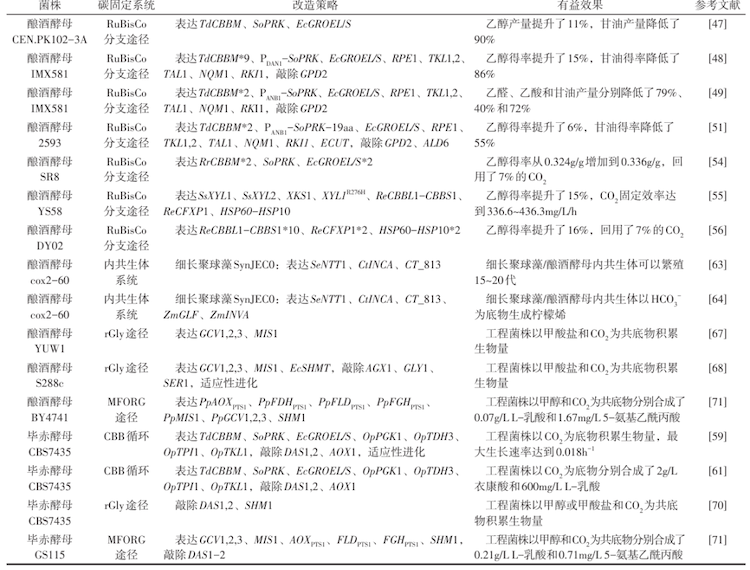
图2
酵母中人工固碳途径的构建
CBB—卡尔文循环;rGly pathway—还原性甘氨酸途径;GAP—甘油醛-3-磷酸;DHAP—二羟丙酮磷酸;SBP—1,7-二磷酸景天庚酮糖;R5P—核酮糖-5-磷酸;S7P—景天庚酮糖-7-磷酸;E4P—赤藓糖-4-磷酸;Xu5P—木酮糖-5-磷酸;Ru5P—核酮糖-5-磷酸;F6P—果糖-6-磷酸;FBP—果糖-1,6-双磷酸;RuBP—核酮糖-1,5-二磷酸;3PGA—3-磷酸甘油酸;1,3BPG—1,3-双磷酸甘油酸;Fba1—果糖-1,6-二磷酸醛缩酶;Shb17—景天庚酮糖-1,7-二磷酸酶;Rki1,2—核糖-5-磷酸酮醇异构酶;Tkl1—转醛酶;Fbp1—果糖-1,6-二磷酸酶;Prk—磷酸核糖激酶;Rpe1,2—D-核酮糖-5-磷酸3-差向异构酶;RuBisCo—核酮糖-1,5-二磷酸羧化酶;Pgk1—磷酸甘油酸激酶;Tdh3—甘油醛-3-磷酸脱氢酶;Ntt1—ADP/ATP转运酶;Glf—葡萄糖转运蛋白;Mis1—三功能亚氨甲基四氢叶酸合成酶、亚甲基四氢叶酸环水解酶和亚甲基四氢叶酸脱氢酶;GCS—甘氨酸裂解/合成系统;Gcv1—甘氨酸裂解系统T亚基(氨甲基转移酶);Gcv2—甘氨酸裂解系统P亚基(甘氨酸脱氢酶);Gcv3—甘氨酸裂解系统H亚基;Lpd—二氢硫辛酰胺脱氢酶;Glycine—甘氨酸
2.1
二氧化碳回用系统的构建
卡尔文(CBB)循环途径中的固碳酶是核酮糖-1,5-二磷酸羧化酶(RuBisCo),其将一分子核酮糖-1,5-二磷酸(RuBP)和一分子CO2转化为两分子3-磷酸甘油酸(3PGA)。在自然界中,RuBisCo一共存在4种不同结构的变体,其中Ⅲ型和Ⅳ型仅具有RuBisCo形式的结构,不具有催化核酮糖-1,5-二磷酸氧合或羧化的功能。酿酒酵母乙醇厌氧生产中,氧化还原失衡会驱动过量NADH氧化形成副产物,如甘油,然而其对维持酵母渗透压有显著作用,因此目前的策略通常旨在减少甘油的形成。利用CO2作为电子受体氧化过量NADH是一种极具吸引力的策略,尤其是可以同乙醇生产耦合时。Guadalupe-Medina等在酿酒酵母中利用游离质粒表达了脱氮硫杆菌(Thiobacillus denitrificans)来源的Ⅱ型RuBisCo编码基因,发现在大肠杆菌伴侣蛋白GroeL/GroeS存在时RuBisCo才能功能性表达,而脱氮硫杆菌来源的伴侣蛋白CbbO2/CbbQ2则不发挥作用。进一步用半乳糖诱导型启动子(PGAL1)驱动菠菜(Spinacia oleracea)来源的磷酸核糖激酶(Prk)编码基因的表达,在酿酒酵母中构建RuBisCo分支途径。在10% CO2的补充下,工程菌株回用CO2可使甘油产量降低90%,乙醇产量提升11%。但是,半乳糖价格昂贵,且存在葡萄糖对半乳糖的抑制,故而Papapetridis等进一步使用厌氧诱导型启动子(PDAN1)替换半乳糖诱导型启动子(PGAL1)驱动磷酸核糖激酶(Prk)编码基因的表达,同时将RuBisCo编码基因拷贝数提升至9个以增强其活性,结果RuBisCo蛋白质丰度提升了10倍,磷酸核糖激酶(Prk)蛋白质丰度降低了9倍。然而,随着生长速率的增加,RuBisCo分支途径对NADH再氧化的作用降低。因此,为进一步降低副产物甘油的含量,敲除了工程菌株中甘油-3-磷酸脱氢酶(Gpd2)编码基因以减少对NADH的竞争。同时,为补充RuBisCo分支途径前体核酮糖-5-磷酸的供给,在工程菌株中过表达了内源磷酸戊糖途径(HMP)酶编码基因。最终菌株可回用CO2将甘油得率降低86%,乙醇得率提升15%。RuBisCo分支途径的高活性同样引发了新的问题,在乙醇生产过程中生成了乙醛和乙酸,并抑制了菌株的生长。这是由于高活性RuBisCo分支途径产生丙酮酸的速率高于NADH的形成速率,因此丙酮酸转化为乙醛和乙酸。为此,van Aalst等将RuBisCo编码基因拷贝数降低至2,并利用生长速率依赖型启动子(PANB1)替换半乳糖诱导型启动子(PGAL1)动态调控磷酸核糖激酶(Prk)编码基因的表达,以降低RuBisCo分支途径活性。优化的RuBisCo分支途径使得工程菌株副产物乙醛、乙酸和甘油产量分别降低了79%、40%和72%。在酿酒酵母乙醇厌氧生产中,另一种用于平衡体内氧化还原的策略是异源乙酰化乙醛脱氢酶(A-Ald)结合内源乙酰辅酶A合成酶(Acs)和乙醇脱氢酶(Adh)催化乙酸生成乙醇。van Aalst等将大肠杆菌来源的乙酰化乙醛脱氢酶(A-Ald)编码基因整合到包含RuBisCo分支途径的工程菌株中,以验证这两种途径能否共同作用,转化由高活性RuBisCo分支途径产生的乙醛和乙酸为产物乙醇。由于内源乙醛脱氢酶(Ald6)会催化乙醛生成乙酸,故而将其敲除,双途径的表达使得工程菌株甘油得率降低了55%,乙醇得率提高了6%。
由于不同底物的同化过程存在途径特异性,因此一些底物发酵时可以产生较葡萄糖更多的NADH,如木糖。酿酒酵母不能天然利用木糖,需要整合异源木糖还原酶(Xr)和木糖醇脱氢酶(Xdh)途径或木糖异构酶(Xi)途径才能实现木糖的利用。其中,木糖还原酶(Xr)和木糖醇脱氢酶(Xdh)途径虽然在木糖消耗速率和乙醇生产等方面更有优势,但是该途径会导致辅因子失衡,进而生成副产物木糖醇和甘油。因此,RuBisCo分支途径也被用于酿酒酵母木糖利用菌株乙醇生产过程中CO2的回用。Xia等在酿酒酵母木糖利用菌株SR8中构建了RuBisCo分支途径并验证其功能性。发现深红红螺菌(Rhodospirillum rubrum)来源的RuBisCo需要大肠杆菌伴侣蛋白GroeL/GroeS才能功能性表达,且将编码基因拷贝数提升至2时,RuBisCo活性最高。然而,在酿酒酵母菌株中单独表达菠菜来源的磷酸核糖激酶(Prk)编码基因时,磷酸核糖激酶(Prk)的催化产物核酮糖-1,5-二磷酸会对细胞产生毒害作用,影响工程菌株以木糖为底物的生长。有趣的是,磷酸核糖激酶(Prk)编码基因的单独表达能提高工程菌株的乙醇产量。将RuBisCo分支途径完整表达后,恢复了工程菌株以木糖为底物的生长,且回用了7%的CO2,使得乙醇得率从0.324 g/g增加到0.336 g/g。Li等首先在酿酒酵母中构建了基于木糖还原酶(Xr)-木糖醇脱氢酶(Xdh)途径的木糖利用途径,同时过表达了木糖还原酶突变体(XrR276H)编码基因,该突变体辅因子偏好性从NADPH转变为NADH,从而降低副产物的生成。在此基础上,筛选并评估了不同来源的RuBisCo在木糖利用菌株中的CO2回用效率,发现由罗尔斯通氏菌(Ralstonia eutropha H16)来源的RuBisCo、磷酸核糖激酶(Prk)和内源伴侣蛋白(Hsp60-Hsp10)构建的RuBisCo分支途径效果更优,在氧限制条件下以木糖和麦芽糖为共底物时乙醇得率提升了15%,CO2回用效率达到336.6~436.3mg/(L·h)。Park等在木糖利用菌株DY2中整合了基于罗尔斯通氏菌的RuBisCo分支途径,并通过δ整合技术提高RuBisCo编码基因拷贝数以提高CO2的回用效率。工程菌株中RuBisCo编码基因拷贝数分布范围在1~10,且拷贝数为10时活性最高,但是高拷贝工程菌株的表型同单拷贝相比没有明显变化,推测是由于RuBisCo分支途径导致其他相关基因表达不足。将磷酸核糖激酶(Prk)和伴侣蛋白(Hsp60-Hsp10)编码基因过表达后,工程菌株回用了7%的CO2,使得乙醇得率增加了16%。
2.2
二氧化碳固定系统的构建
卡尔文(CBB)循环是自然界中最主要的碳固定途径,负责固定大约90%的无机碳转化为生物质,且酶促反应步骤相对较少,因此与其他碳固定途径相比研究的更广泛。毕赤酵母是甲基营养型酵母,可以通过木糖单磷酸(XuMP)循环利用甲醇形成生物质,或通过异化途径氧化为CO2,同时产生NADH。其中,XuMP循环和CBB循环具有相同的整体拓扑结构,并共享多种酶促反应,使得在毕赤酵母中仅添加6步酶促反应就可以将XuMP循环转化为CBB循环。Gassler等在毕赤酵母中异源表达了包括脱氮硫杆菌(Thiobacillus denitrificans)来源的RuBisCo在内的6种编码基因,构建了完整的CBB循环。且由于XuMP循环位于过氧化物酶体,因此将异源CBB循环酶锚定于过氧化物酶体,以增强CBB循环的CO2固定效率。CBB循环由甲醇的异化途径提供NADH和ATP,为阻止工程菌株对甲醇的同化,敲除了二羟基丙酮合酶(Das1,2)编码基因。上述策略的实施成功构建一株化能自养型毕赤酵母工程菌株,该菌株以CO2为底物时,最大生长速率达到0.008h-1,且通过适应性进化提升到0.018h-1。随后,对进化菌株进行基因组测序并采取反向代谢工程以验证其生长改善的因素,发现磷酸核糖激酶(Prk)和烟酸单核苷酸腺苷酰转移酶(Nma1)突变对于ATP可用性的改善,以及过氧化物酶体靶向信号受体(Pex5)突变增强过氧化物酶体靶向蛋白的输入是进化菌株表型改变的主要原因。Baumschabl等进一步评估了毕赤酵母自养菌株以CO2为底物生产有机酸的能力。通过引入衣康酸或L-乳酸合成途径后,工程菌株以CO2为底物分别合成了2g/L的衣康酸和600mg/L的L-乳酸,证明了利用自养型毕赤酵母以CO2作为原料生产增值化学品的潜力。
将异养微生物转化为自养微生物通常需要将繁杂的碳固定途径整合到体内。Cournoyer等基于内共生体理论设计了一种细长聚球藻(Synechococcus elongatus)/酿酒酵母内共生体,该内共生体系统中细长聚球藻负责吸收光能和CO2为酿酒酵母提供生长所需的ATP,酿酒酵母则为细长聚球藻提供生长所需的代谢物。这一过程的实现主要依赖生物能量因素,即细长聚球藻具有的ADP/ATP转运酶(Ntt1),可以有效转化ADP为ATP,恢复酿酒酵母因缺乏细胞色素c氧化酶复合体引发的呼吸缺陷型表型,同时ADP/ATP转运酶的过表达可以增强内共生体系统的稳定性。在细长聚球藻中异源表达沙眼衣原体(Chlamydia trachomatis)来源的SNARE型蛋白编码基因(INCA,CT_813)阻止其在酿酒酵母宿主细胞中的降解后,最优的内共生体可以繁殖15~20代。Gao等在上述研究的基础上进一步异源表达了运动发酵单胞菌(Zymomonas mobilis)来源的葡萄糖转运蛋白(Glf)和转化酶(InvA)编码基因,将细长聚球藻通过光合作用积累的蔗糖分解为葡萄糖和果糖,并将葡萄糖转运到酿酒酵母胞质中作为酿酒酵母的碳源。在内共生体的宿主细胞酿酒酵母中引入柠檬烯合成途径后,内共生体以HCO3-为底物的发酵检测到柠檬烯的生成,证明了在光合条件下使用内共生体生物合成天然产物的可行性。
近期的研究中,还原性甘氨酸(rGly)途径允许脱硫弧菌(Desulfovibrio desulfuricans)实现化能自养,也因此证实该途径是在自然界中被发现的第七种CO2固定途径。该途径中,甲酸首先和四氢叶酸(THF)结合并被还原为亚甲基四氢叶酸(5,10-CH2-THF),随后后者的C1部分在途径关键酶甘氨酸裂解/合成系统(GCS)的催化下和CO2以及NH3缩合生成甘氨酸,并逐步转化为丝氨酸和丙酮酸。酿酒酵母中天然存在rGly途径的途径酶,但是不能以甲酸盐为底物生长。De La Cruz等在酿酒酵母中过表达内源甘氨酸裂解/合成系统亚基(Gcv1, Gcv2, Gcv3)和将甲酸盐转化为亚甲基四氢叶酸的三功能酶(Mis1)编码基因,激活了rGly途径,并发现仅在高浓度CO2的补充下rGly途径才能同化甲酸盐和CO2生成甘氨酸,并恢复甘氨酸缺陷型菌株的生长。这是由于甘氨酸裂解/合成系统是可逆的,高浓度的CO2才能满足该酶在还原方向上动力学和热力学的需求。采取类似的策略,Bysani等在酿酒酵母中敲除丝氨酸合成途径编码基因,构建了一株含有丝氨酸传感器的工程菌株,该菌株在甘氨酸或丝氨酸的补充下才能以葡萄糖为底物正常生长。随后在含有丝氨酸传感器的工程菌株中整合内源的rGly途径酶以及大肠杆菌(Escherichia coli)来源的羟甲基转移酶(Shmt)编码基因连接甲酸盐到丝氨酸的代谢通路,并采取适应性进化增强工程菌株对rGly途径的依赖性生长,进化菌株可以以甲酸盐和CO2为共底物积累生物量。全基因组测序和反向代谢工程验证发现谷氨酸脱氢酶1(Gdh1)的突变是促进进化菌株rGly途径依赖性生长的主要原因。
在毕赤酵母中,甲醇的主要同化途径是XuMP循环,并且已经得到详细的研究。Mitic等利用13C标记的甲醇培养二羟丙酮合酶(Das1,2)编码基因缺失的毕赤酵母工程菌株,发现一条具有活性的甲醇同化替代途径,即rGly途径。敲除线粒体羟甲基转移酶(Shm1)编码基因限制其和rGly途径对亚甲基四氢叶酸的竞争后,工程菌株可以以甲醇或甲酸盐和高浓度CO2为底物积累生物量。Guo等基于甲醇和甲酸的氧化以及rGly途径在毕赤酵母中设计了一条MFORG途径。该途径的构建包括将内源醇氧化酶(Aox)、甲醛脱氢酶(Fld)以及S-甲酰谷胱甘肽水解酶(Fgh)锚定在过氧化物酶体中增强甲醇到甲酸的转化,随后进一步过表达内源rGly途径酶以及羟甲基转移酶(Shm1)编码基因强化甲酸到丙酮酸的代谢通路。同时,为阻止工程菌株对甲醇的同化,敲除了二羟基丙酮合酶(Das1, 2)编码基因。最终菌株在以甲醇和NaHCO3为共底物时分别合成了0.21g/L的L-乳酸和0.71mg/L的5-氨基乙酰丙酸。随后,MFORG途径被拓展应用到酿酒酵母中,并实现酿酒酵母以甲醇和NaHCO3为共底物积累生物量,并以此为底盘分别合成了0.07g/L的L-乳酸和1.67mg/L的5-氨基乙酰丙酸。
03
结语与展望
酵母是面向生物制造的合成生物学研究中一类重要的底盘微生物,在工业生产中已被用于萜烯、脂肪酸等化合物的生物制造。对酵母的天然碳代谢途径进行改造以实现更大程度的碳保存,并通过构建人工途径将无机碳转化为有机碳从而实现碳固定是进一步减少碳排放的有效途径。本文综述了近年来利用合成生物学手段在酵母中构建碳保存和碳固定系统的研究进展,重点介绍了以酿酒酵母、解脂耶氏酵母和毕赤酵母为代表的酵母菌株代谢过程中碳保存和碳固定的合成生物学改造策略。
为了进一步推动酵母的低碳生物制造,强化其在工业生产中的主体地位,需要持续应用合成生物学的方法指导酵母细胞工厂的改造。一是持续开发碳固定途径关键元件,提高碳固定途径在酵母中的可用性。包括强化固碳酶的固碳性能,对于固碳酶的定向进化可以开发菌株特异性或性能优越的固碳酶变体,或者通过理性设计构建人工固碳酶,增强CO2的固定效率;进一步持续挖掘自然界中尚未发现的碳固定途径,以构建更加高效的或适配特定产物的人工固碳途径。二是有效的结合系统生物学、基因组学以及代谢组学等方法,以获得对酵母更全面的理解,释放酵母天然碳固定的潜力,进一步结合碳固定途径,实现酵母的自养生长和产物合成。同时,CO2是高度氧化的产物,光能的有效利用可以进一步降低辅助底物的利用,并通过构建光驱微生物固碳体系实现碳负性的工业生产。
▌参考信息:本文部分素材来自《化工进展》。由作者重新编写,系作者个人观点,本平台发布仅为了传达一种不同观点,不代表对该观点赞同或支持。如果有任何问题,请联系我们:15356747796(微信同号)




