中科院青岛能源所李福利等:以CO2为原料的第三代生物炼制现状

利用微生物发酵一碳气体生产生物燃料及化学品,是当今实现碳资源捕捉利用和绿色生物制造的重要途径之一。CO2和CO、甲烷、甲醇以及甲酸等含有一个碳原子的物质被称为一碳(one carbon,C1)资源,其来源广泛且价格低廉,有望成为生物制造的替代原料。C1原料生物转化有助于缓解温室效应、助力“碳中和”目标。
【SynBioCon】获悉,近日,中国科学院青岛生物能源与过程研究所李福利研究员等人在《化工进展》上发表《以CO2为原料的第三代生物炼制现状》一文。
文章总结了近年来以CO2为原料通过微生物炼制生产重要能源和化学品的研究进展,论述CO2的生物代谢途径以及产物合成途径,讨论以CO2为原料的C1生物炼制中微生物的工程化改造,并展望未来绿色生物制造的新路线。

化石能源的使用与开发带动了现代工业蓬勃发展,但同时排放了大量二氧化碳(CO2),加剧温室效应,造成全球变暖等气候问题。CO2、CO和CH4等同属于一碳气体,主要源于化石燃料的不完全燃烧,如生物质气化、生活废气和冶炼等重工业生产的尾气。据《BP世界能源展望》2024年版报道,2020年到2024年间,全球年均CO2排放量超过400亿吨,预计2030年全球碳排放量达到峰值。近几年,随着我国“双碳”战略的提出,绿色低碳技术的创新和发展成为当今热门的话题与方向。
目前,传统生物炼制技术(以玉米、小麦等粮食作物或以木质纤维素为原料)存在原料利用效率低、成本高及土地利用变化导致的碳债问题。与之相比,“第三代生物炼制”路线愈加受到重视。该技术旨在构建微生物细胞工厂,利用光能、电能和化学能等可再生能源,将大气中的CO2转化为燃料及化学品。该技术反应条件温和,产物选择性高,并能够实现碳固定与碳转化的同步进行。
迄今为止,第三代生物炼制技术取得重要进展,超过10种自然及人工合成的碳固定途径得到验证,部分CO2固定技术已成功实现商业化(图1)。2016年,全球首套4.5×104t/a钢铁工业尾气生物发酵制燃料乙醇商业化项目在河北省唐山市曹妃甸首钢京唐公司开工建设。项目投产后,每年可为企业减少约17×104t CO2排放。2021年,全球首套利用铁合金工业尾气制燃料乙醇项目在宁夏平罗县正式投产,项目每年降低CO2排放量约18×104t,年产燃料乙醇4.5×104t,蛋白粉5000t。上述例子采用了第三代生物炼制技术,该技术利用化能自养微生物作为细胞工厂,实现了乙醇和蛋白饲料等产品的商业化生产。
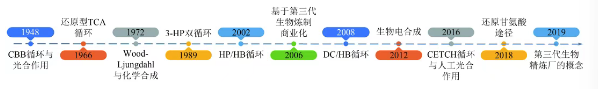
图1
第三代生物炼制技术发展里程碑
自养微生物依据其能量来源可以分为化能自养微生物和光合自养微生物。尽管它们具备使用CO2作为唯一碳源的能力,但通常生长速度较慢,碳固定效率较低,从而限制了它们合成产物的能力。为了实现CO2的高效利用,研究者们开发适用于自养微生物的合成生物学工具,如建立CRISPR基因编辑工具或关键元件的定向进化等,利用基因编辑手段对自养微生物进行改造以实现对目标产物的高效合成。此外,相较于自养微生物,异养微生物基因编辑工具的研究更为系统,对“异养菌”进行“自养化”改造可以用于更多种类产品的生物合成。例如,大肠杆菌和毕赤酵母已经成功实现自养化改造,并通过基因编辑在毕赤酵母中实现了以CO2为原料的乙酸生物合成。同样,CH4与CO等其他一碳气体的生物转化也取得一些进展,部分成果成功商业化。
本文汇总了当前CO2为原料的第三代生物炼制的最新研究进展,总结了已验证的自然及人工固碳途径,并分析了其在生物炼制的应用潜力。此外,结合实际案例,本文还探讨了目前固碳微生物工程化改造技术。
01
生物炼制技术的发展历程
早在1970年代,石油危机推动了生物燃料的研究与产业化。石油供应的限制和价格上涨促使各国和地区,特别是巴西、美国和欧洲,开始关注替代能源的开发。以巴西为例,政府为减轻石油进口的依赖,于1975年起实施乙醇代替汽油的计划,利用本国丰富的甘蔗资源生产生物乙醇。1982年,“生物炼制”的概念首次被提出,随着化石能源的过度使用,能源、资源和环境问题日趋严峻,越来越多的国家将生物炼制技术作为战略性研究方向。1990年代,基于“生物炼制工厂”概念的多产品模式成为研究热点。1998年,美国通过《生物质能源和生物基产品研究发展法案》,推动了通过细胞工厂将生物质转化为乙醇等生物燃料的研究和生产。此外,随着农业技术的进步,玉米等原料的产量增加,为生物燃料的工业化提供了一定的资源供应。
以玉米、油料作物等可再生生物质为原料的“第一代”生物炼制技术,有助于减少化石燃料的使用以及CO2的排放,并改善能源安全。但人们对原料的来源存在担忧,包括对生物多样性、土地利用变化以及与粮食作物的竞争等问题。这种担忧限制了第一代生物燃料的生产,此外,曾有研究指出,生物柴油不是一种具有成本效益的减排技术。因此,迫切需要开发一种廉价且非食品的材料作为原料生产燃料和化学品。木质纤维素原料具有转化为新型生物燃料的能力,即“第二代”生物燃料。木质纤维素类生物质包括木材、农业秸秆及其加工废弃物,作为地球上最丰富且未被充分利用的生物资源之一,已被广泛认可为一种具有潜力的能源和原料来源。从基础层面分析,植物生物质可通过直接燃烧转化为热能及电能。然而,在液体生物燃料的生产中,植物生物质展现出更为显著的潜力。这一转化过程不仅能够提高能源的利用效率,还有助于减少对化石燃料的依赖,从而在可再生能源领域中占据重要地位。但目前植物生物质的利用还存在许多技术障碍,如木质纤维素结构的复杂性极大地限制了其在实际生产中的应用。第二代生物炼制技术虽然在理论上提供了一种将木质纤维素生物质转化为能源和化学品的途径,但在实际应用中面临高成本、高能耗水耗、环境影响以及技术成熟度不足等问题,导致其经济可行性受限。因此,开发第三代生物炼制技术显得尤为必要。
第三代生物炼制技术通过利用CO2和H2、光能等可再生能源作为碳源和能量来源,旨在实现可持续、成本效益更高、环境友好的生产过程,该技术不仅能够克服第二代技术的局限,还能推动相关技术创新,为生物制造领域带来新的突破。与前两代生物炼制技术的原料相比,CO2作为底物不仅更加丰富廉价,同时可以减少大气中CO2的含量,从而缓解温室效应。因此,第三代生物炼制技术被认为是缓解化石能源枯竭和温室效应的有效途径之一。通过该技术可生产甲酸、甲醇等C1化学品;也可以进一步延伸碳链,生产多元醇、酸及生物基聚合物等高附加值产品。
进入21世纪,第三代生物炼制技术取得了显著进展,尤其是在基因编辑、发酵培养、油脂提取和生物燃料转化技术方面,生产效率得到了大幅提升。例如,利用光生物反应器培养微藻,单位面积产量提高了20~30倍。在用于第三代生物炼制的各类细胞工厂中,不同微生物的生产能力和转化效率因种类和工程策略的不同而有所差异。
例如,经代谢工程改造的酿酒酵母可实现利用CO2高效合成脂肪酸乙酯,其产量可达50~70g/L,而工程大肠杆菌同样能够合成30~50g/L的脂肪酸乙酯,并可进一步精炼为生物柴油。除了利用单一细胞工厂进行生物炼制外,细胞共培养系统的开发使得碳转化率进一步提升。例如,在微藻-大肠杆菌共培养系统中可实现更高效的碳循环,CO2的转化效率提升至35%~40%,该系统的脂肪酸等产物的产率比单一微生物培养提高约20%。
02
目前已知的CO2固定途径
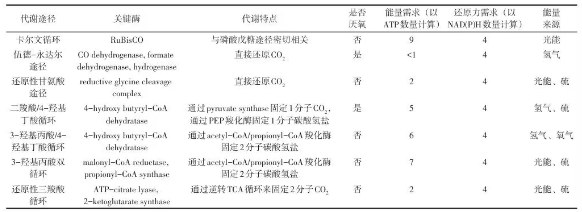
目前已经发现或人工构建得到的固碳途径已超过10个,其中7种天然存在的固碳途径包括卡尔文循环(Calvin-Benson-Bassham cycle,CBB cycle)、伍德-永达尔途径(Wood-Ljungdahl pathway,WLP)、还原性甘氨酸途径(reductive glycine pathway)、二羧酸/4-羟基丁酸循环(dicarboxylate/4-hydroxybutyrate cycle,DC/HB cycle)、3-羟基丙酸/4-羟基丁酸循环(3-hydroxypropionate/4-hydroxybutyrate cycle,HP/HB cycle)、3-羟基丙酸双循环(3-hydroxypropionate bicycle,3-HP bicycle)以及还原性三羧酸循环(Reductive TCA cycle)。每种代谢途径的特征见表1。
不同代谢途径特点
2.1
卡尔文循环
卡尔文循环又称为还原戊糖磷酸循环(图2)。卡尔文循环利用光反应产生的驱动力ATP与还原力NADPH,将空气中的CO2固定成为蔗糖、淀粉等碳水化合物。CO2在RuBisco(核酮糖-1,5-二磷酸羧化酶/加氧酶)的催化作用下羧化五碳底物,并裂解为两分子的3-磷酸甘油酸。在碳还原阶段,3-磷酸甘油酸在3-磷酸甘油酸激酶(PGK)以及3-磷酸甘油醛脱氢酶(GAPDH)的作用下还原为3-磷酸甘油醛;底物生成阶段,一部分3-磷酸甘油醛合成蔗糖与淀粉,另一部分则经过一系列反应生成1,5-二磷酸核酮糖(RuBP)。
卡尔文循环中的关键酶是RuBisco,该酶在动力学上效率比较低,且在固碳过程中会催化与O2的副反应。该反应将O2加到RuBP上,生成3-磷酸甘油酸和磷酸乙醇酸,磷酸乙醇酸在过氧化物酶体和线粒体中酶的催化下生成CO2,该好氧反应称为光呼吸,该过程需要额外消耗40%~50%的ATP和NADPH并释放CO2。由于该酶为多亚基复合体,难以进行人工改造。该途径存在于多种植物、藻类、蓝细菌体内,是自然界固碳途径中重要的一环。
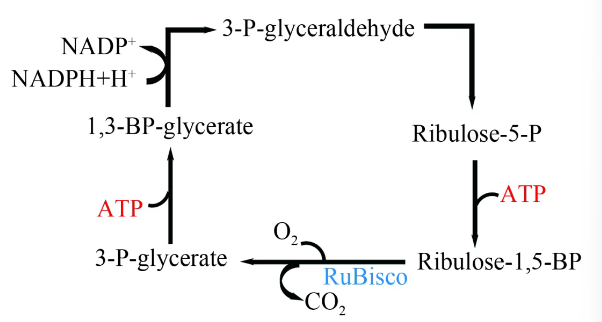
图2
卡尔文循环代谢示意图
Ribulose-5-P—5-磷酸核酮糖;Ribulose-1,5-BP—1,5-二磷酸核酮糖;3-P-glycerate—3-磷酸甘油酸;1,3-BP-glycerate—1,3-二磷酸甘油酸;3-P-glyceraldehyde—3-磷酸甘油醛
2.2
伍德-永达尔途径
伍德-永达尔途径又称为还原性乙酰辅酶A途径(图3),主要存在于某些产乙酸的厌氧细菌中。该代谢途径利用H2或CO作为电子供体,固定CO2生成乙酰辅酶A,进而生成乙酸、乙醇等衍生物。该途径被认作最古老的固碳途径之一,由甲基分支和羰基分支两个线性分支组成。在甲基分支中,一个CO2分子进入后首先被甲酸脱氢酶还原为甲酸,之后经过一系列的还原反应,最终还原生成5-甲基四氢叶酸,然后由甲基转移酶催化,甲基被转移到钴铁硫蛋白(CoFeSP)上,形成5-甲基-CoFeSP,四氢叶酸脱下后进入新的循环;在羰基分支中,一个CO2分子被一氧化碳脱氢酶还原生成CO,最后在一氧化碳脱氢酶/乙酰辅酶A合酶的催化下,5-甲基-CoFeSP的甲基与CO和辅酶A结合,生成乙酰辅酶A。其中,伍德-永达尔途径某些关键步骤涉及电子传递及ATP的合成。例如,产乙酸菌中Rnf复合体介导的电子传递产生离子梯度,离子梯度进而偶联ATP合酶产生ATP,因此,伍德-永达尔途径与胞内能量代谢相偶联,为细菌自养代谢提供必要的能量。
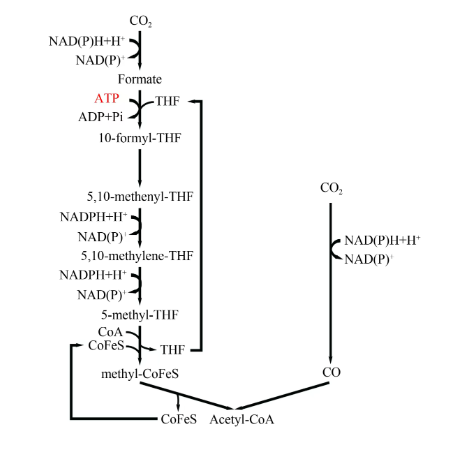
图3
伍德-永达尔途径
Formate—甲酸;10-formyl-THF—10-甲酰四氢叶酸;5,10-methenyl-THF—5,10-次甲基四氢叶酸;5,10-methylene-THF—5,10-亚甲基四氢叶酸;5-methyl-THF—5-甲基四氢叶酸;CoFeS—钴铁硫蛋白;Acetyl-CoA—乙酰辅酶A
2.3
还原性甘氨酸途径
2020年,Irene Sánchez-Andrea等通过多组学分析证实,在Desulfovibrio desulfuricans中存在天然的还原性甘氨酸途径(图4),且D. desulfuricans可以利用该途径进行自养生长。在该途径中,二氧化碳首先在甲酸脱氢酶的作用下被还原成甲酸,随后甲酸与四氢叶酸(tetrahydrofolate,THF)结合,形成甲酰四氢叶酸,这一步骤由甲酸-四氢叶酸(FTL)合成酶(formyl-THF synthetase,FTS)催化。甲酰四氢叶酸在甲酰四氢叶酸环水合酶(formyl-THF cyclohydrolase,FTCD)的作用下进一步转化为亚甲基-THF,这是甘氨酸裂解系统(glycine cleavage/synthase system,GCS)直接用于还原羧基化的底物。 然后,甘氨酸裂解系统(GCS)在还原羧基化方向上将甲酸、氨和二氧化碳转化为甘氨酸。甘氨酸可以由丝氨酸羟甲基转移酶(serine hydroxymethyltransferase,SHMT)转化为丝氨酸,丝氨酸进一步通过丝氨酸脱氨酶(serine deaminase,SDA)形成丙酮酸。还原甘氨酸途径被认为是固碳途径中具有优势的途径之一,因为它的反应步骤较少,ATP需求较低,途径中的酶对氧气的耐受性较好,对中心代谢的干扰小,显示出较好的工业应用潜力。近期,该途径已在大肠杆菌(Escherichia coli)、酿酒酵母(Saccharomyces cerevisiae)、德雷克梭菌(Clostridium drakei)等微生物中成功表达,改造后细胞能够利用甲酸和CO2合成有机酸及氨基酸等初级代谢产物。
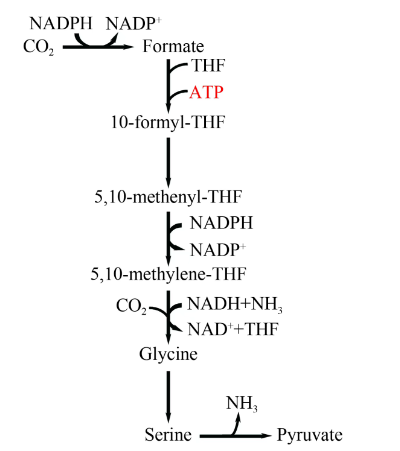
图4
还原性甘氨酸途径
Formate—甲酸;THF—四氢叶酸;10-formyl-THF—10-甲酰四氢叶酸;5,10-methenyl-THF—5,10-次甲基四氢叶酸;5,10-methylene-THF—5,10-亚甲基四氢叶酸;Glycine—甘氨酸;SHMT—丝氨酸羟甲基转移酶;Serine—丝氨酸;Pyruvate—丙酮酸
2.4
二羧酸/4-羟基丁酸循环
Harald Huber等于2008年报道了一种在Ignicoccus hospitalis中发现的CO2固定途径(图5),即二羧酸/4-羟基丁酸循环(DC/4HB)途径。该途径以1分子乙酰辅酶A为起点,经过一系列的反应,固定CO2生成2分子乙酰辅酶A。其具体代谢过程如下:首先,该循环从乙酰辅酶A开始,通过丙酮酸合酶的作用,将乙酰辅酶A与CO2结合,并还原羧化形成丙酮酸,丙酮酸随后转化为磷酸烯醇式丙酮酸;接着,磷酸烯醇式丙酮酸在羧化酶的催化下进一步转化为草酰乙酸,后者进一步转化为苹果酸(malate)、延胡索酸(fumarate)和琥珀酸(succinate),这些C4二羧酸(DC)是循环中的中间产物;琥珀酸进而激活为琥珀酰CoA,进一步被还原为4-羟基丁酸(4HB),该步骤需要4-羟基丁酰辅酶A合酶的参与;4-羟基丁酸随后被激活为4-羟基丁酰辅酶A,在4-羟基丁酰辅酶A脱水酶的作用下,4-羟基丁酰辅酶A脱水生成丙烯辅酶A;丙烯辅酶A接着水合成为(S)-3-羟基丁酰辅酶A;最后,(S)-3-羟基丁酰辅酶A在(S)-3-羟基丁酰辅酶A脱氢酶的作用下被氧化,并在乙酰乙酰辅酶A硫解酶的催化下,最终生成两个乙酰辅酶A分子。
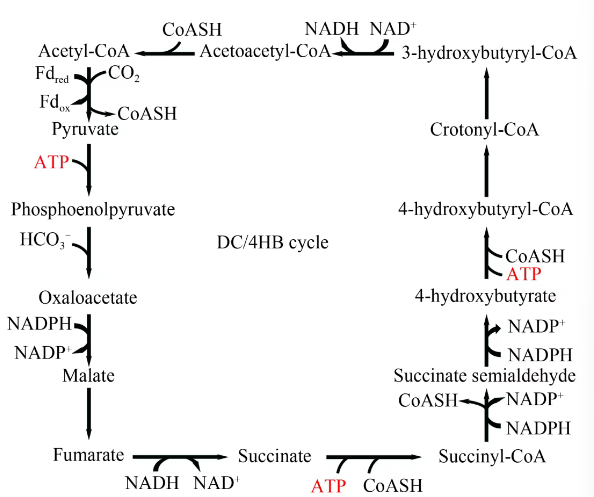
图5
DC/4HB 循环
Acetyl-CoA—乙酰辅酶A;Pyruvate—丙酮酸;Phosphoenolpyruvate—磷酸烯醇式丙酮酸;Oxaloacetate—草酰乙酸;Malate—苹果酸;Fumarate—延胡索酸;Succinate—琥珀酸;Succinate semialdehyde—琥珀酸半醛;4-hydroxybutyrate—4-羟基丁酸;Crotonyl-CoA—巴豆酰辅酶A;3-hydroxybutyryl-CoA—3-羟基丙酰辅酶A;Acetoacetyl-CoA—乙酰乙酰辅酶A
整个DC/4HB途径是一个循环,它不仅再生了原始的乙酰辅酶A,还额外生成了一分子乙酰辅酶A,从而实现了二氧化碳的固定和有机物质的合成。这个循环在能量消耗、电子载体的使用以及活性二氧化碳物种方面与其他自养生化途径有所不同,显示出其独特的效率和适应性。
2.5
3-羟基丙酸/4-羟基丁酸循环
2007年,Ivan A Berg等在《Science》上报道了他们在古菌Metallosphaera sedula中发现的一种新的固碳途径(图6),即3-羟基丙酸/4-羟基丁酸(3HP/4HB)循环。该途径中的关键酶是4-羟基丁酰CoA脱水酶。该途径常见于极端嗜热的古菌中,且可以在好氧或厌氧条件下发挥作用。
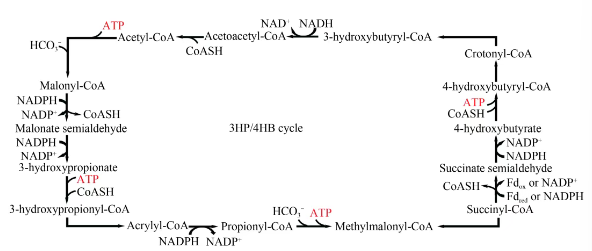
图6
3HP/4HB循环
Acetyl-CoA—乙酰辅酶A;Malonyl-CoA—丙二酰辅酶A;Malonate semialdehyde—丙二酰半醛;3-hydroxypropionate—3-羟基丙酸;3-hydroxypropionyl-CoA—3-羟基丁酰辅酶A;Acrylyl-CoA—丙烯酰辅酶A;Propionyl-CoA—丙酰辅酶A;Methylmalonyl-CoA—甲基丙二酰辅酶A;Succinyl-CoA—琥珀酰辅酶A;Succinate semialdehyde—琥珀酸半醛;4-hydroxybutyrate—4-羟基丁酸;Crotonyl-CoA—巴豆酰辅酶A;3-hydroxybutyryl-CoA—3-羟基丙酰辅酶A;Acetoacetyl-CoA—乙酰乙酰辅酶A
3HP/4HB途径起始于乙酰辅酶A,经乙酰辅酶A羧化酶羧化,生成丙二酰辅酶A;接着,丙二酰辅酶A在丙二酰辅酶A还原酶的作用下还原为丙醛酸半醛,并进一步还原为3-羟基丙酸(3HP);3HP进一步还原为丙酰辅酶A,随后在羧化酶的催化下生成甲基丙二酰辅酶A并进一步转化为琥珀酰辅酶A;琥珀酰辅酶A在琥珀酰辅酶A还原酶的作用下还原为琥珀酸半醛,进而在琥珀酸半醛还原酶的作用下还原为4-羟基丁酸(4HB);4-羟基丁酸在4-羟基丁酰辅酶A合酶的作用下转化为4-羟基丁酰辅酶A,并通过4-羟基丁酰辅酶A脱水酶的作用生成巴豆酰辅酶A;巴豆酰辅酶A在巴豆酰辅酶A水合酶的作用下水合为(S)-3-羟基丁酰辅酶A;最终,(S)-3-羟基丁酰辅酶A在(S)-3-羟基丁酰辅酶A脱氢酶的作用下氧化为乙酰辅酶A。
通过这个循环,一个乙酰辅酶A和两分子碳酸氢盐最终转化为两个乙酰辅酶A分子,实现了二氧化碳的固定和有机物质的合成。这个循环在能量效率和酶的催化效率方面与其他已知的二氧化碳固定途径有所不同,对于理解古菌在地球碳循环中的作用具有重要意义。
2.6
3-羟基丙酸双循环
3-羟基丙酸(3-HP)双循环是在光合细菌Chloroflexus aurantiacus中发现的一种固碳途径(图7),该途径从乙酰辅酶A开始,利用乙酰辅酶A和丙酰辅酶A为第一,第二CO2受体分子,并最终固定两分子的CO2,生成一分子的丙酮酸与一分子的乙酰辅酶A。Jan Zarzycki等阐明了C. aurantiacus中的3-HP循环,该途径具体代谢过程如下:在第一个循环中,一分子HCO3-与乙酰辅酶A结合生成丙二酰辅酶A;丙二酰辅酶A进而生成3-羟丙酰辅酶A,后被还原为丙酰辅酶A。其中一分子丙酰辅酶A作为第二CO2受体分子接受一分子HCO3-生成甲基丙二酰辅酶A继续第一循环,最终生成一分子乙酰辅酶A并脱去一分子乙醛酸;另一分子的丙酰辅酶A接受第一循环的乙醛酸缩合成β-甲基苹果酰辅酶A进入第二循环,最终生成丙酮酸与乙酰辅酶A完成第二循环。
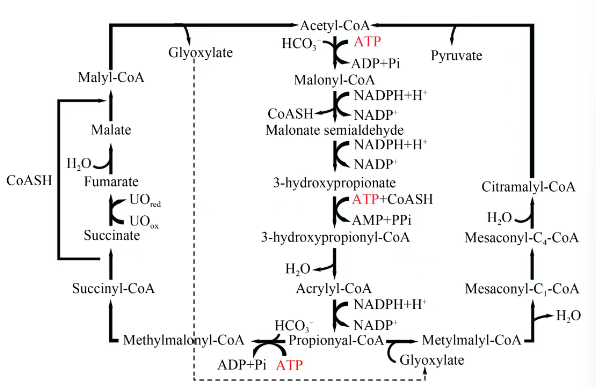
图7
3-HP双循环
Acetyl-CoA—乙酰辅酶A;Malonyl-CoA—丙二酰辅酶A;Malonate semialdehyde—丙二酸半醛;3-hydroxypropionyl-CoA—3-羟基丙酰辅酶A;Acrylyl-CoA—丙烯酰辅酶A;Propionyal-CoA—丙酰辅酶A;第一循环—Methylmalonyl-CoA—甲基丙二酰辅酶A;Succinyl-CoA—琥珀酰辅酶A;Succinate—琥珀酸;UOred/UOox—某还原态蛋白/某氧化态蛋白;Fumarate—延胡索酸;Malate—苹果酸;Malyl-CoA—苹果酰辅酶A;Glyoxylate—乙醛酸;第二循环—Metylmalyl-CoA—甲基苹果酰辅酶A;Mesaconyl-CoA—中康酰辅酶A;Citramalyl-CoA—柠苹酸辅酶A;Pyruvate—丙酮酸
在C. aurantiacus中,3-HP双循环不仅适合于自养生长中的二氧化碳固定,还适合于同化各种有机底物,如甘氨酸、乙酸、丙酸、3-羟基丙酸、乳酸、丁酸或琥珀酸。这些有机底物通过3-HP双循环和乙二醇酸循环一起被导入中心碳代谢。当细胞以这些有机底物为唯一碳源异养生长时,3-HP双循环中的酶活性仅受到轻微影响。这表明C. aurantiacus能够利用3-HP双循环迅速同化多种有机酸,并且这些有机酸可以作为碳源被细胞利用。
总结来说,3-HP双循环是一个复杂而高效的代谢途径,它不仅能够固定二氧化碳,还能够将多种有机底物整合到中心碳代谢中,为C. aurantiacus提供了一种灵活的碳利用策略。
2.7
还原TCA循环
还原TCA循环常见于厌氧细菌以及古菌中,其独特的还原循环揭示了还原TCA循环或为早期地球上普遍存在的代谢途径之一(图8)。该途径通过TCA循环的逆反应固定两分子的CO2,其中的关键酶是ATP-柠檬酸裂解酶和两-酮戊二酸合成酶。一般认为TCA中的柠檬酸合成酶驱动的柠檬酸合成途径为不可逆反应,但目前有研究表明,自然界中还是存在双向催化的柠檬酸合成酶。该途径具体代谢过程如下:首先,琥珀酰辅酶A依次接受两个CO2,并在乌头酸异构酶催化下生成柠檬酸;柠檬酸通过ATP-柠檬酸裂解酶催化下分裂成乙酰辅酶A和草酰乙酸,后者进而通过TCA循环的逆反应重新生成琥珀酰辅酶A完成循环。部分研究表明,通过合理调控TCA循环与还原TCA循环中关键能量代谢步骤,可以实现中间产物琥珀酸的高水平合成。
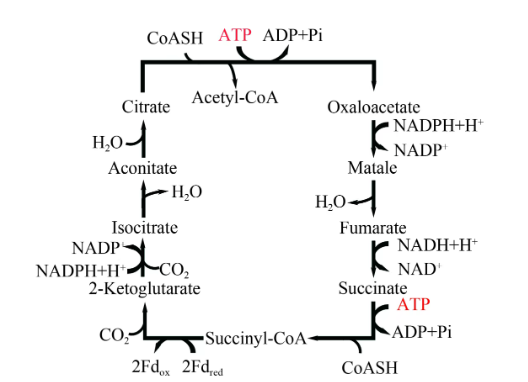
图8
还原TCA循环
Succinate—琥珀酸;Succinyl-CoA—琥珀酰辅酶A;Fdred/Fdox—还原/氧化态铁氧还蛋白;2-Ketoglutarate—2-酮戊二酸;Isocitrate—异柠檬酸;Aconitate—乌头酸;Citrate—柠檬酸;Acetyl-CoA—乙酰辅酶A;Oxaloacetate—草酰乙酸;Matale—苹果酸;Fumarate—延胡索酸
2.8
人工固碳途径
除上述7种自然固碳途径外,另外还有多种人工设计的固碳途径,如:人工合成淀粉途径(Artificial starch anabolic pathway,ASAP),该途径为人工设计的无细胞体系的固碳途径,包含了11个核心反应模块,将CO2转化生成淀粉;CETCH循环则是重建了来自9种生物的17种酶,该途径通过丁酰辅酶A羧化/还原酶固定CO2,其固碳效率远强于RuBisCo,且该途径能量消耗小于CBB循环,大约降低了40%的能量消耗;THETA循环是一种创新的合成代谢途径,它通过一系列精确设计的酶促反应将二氧化碳转化为乙酰辅酶A,其关键酶为磷酸烯醇丙酮酸羧化激酶和巴豆酰辅酶A羧化酶/还原酶;POAP(PYCOAH-ACS-PFOR)循环是由所涉及的酶命名的,该途径是一个由丙酮酸羧化酶、草酰乙酸乙酰水解酶、乙酸-辅酶A连接酶和丙酮酸合成酶催化的四个步骤组成的最小的人工固碳途径,利用甲醇和二氧化碳实现了甘氨酸、丝氨酸和丙酮酸的高效合成;ICE-CAP(Integrated chemoenzymatic CO2 to amino-acid pathway)实现了迄今为止最高的生物固碳速率,其核心是甘氨酸裂解体系,通过生物催化与化学催化的整合,克服了固碳途径中的热力学能量限制,实现了甘氨酸的高效合成。
03
生物固碳的工程化
3.1
生物固碳的关键影响因素
在Liu等的研究中,对不同固碳途径的优劣性进行了详尽的分析,涵盖了能量来源、底物与产物的种类、关键酶的类型及其活性等多个维度。该研究特别强调了固碳途径在实际应用时需考虑的关键因素,包括氧气敏感性、ATP的需求、热力学限制、酶动力学特性以及CO2的利用方式。这些因素对于提高固碳效率和优化生物炼制过程具有重要的指导意义。在氧气的存在下是否具有代谢能力,是区分不同固碳途径的重要因素之一。例如,WLP中的CO脱氢酶、氢化酶以及电子载体铁氧还蛋白所具有的Fe-S簇对氧气十分敏感,因此该途径只能在严格厌氧的环境下运行。相比之下,卡尔文循环、还原甘氨酸途径等可以在有氧条件下进行。
第三代生物炼制中,能量供给是一个关键问题。
不同固碳途径对其ATP的需求不同。在好氧代谢途径中,呼吸链通常需要大量的还原力来提供ATP,从而减少对CO2的还原力供应。而在厌氧代谢途径中,厌氧生物因其ATP产率低,生长速率低,生物质积累少而导致难以产生能量密集的产品。ATP在不同代谢途径中的需求,主要源自还原当量和电子供体。在生物化学反应中,铁氧还蛋白(铁氧还蛋白的氧化还原电势E0'为-450mV)相较于烟酰胺腺嘌呤二核苷酸(NADH,氧化还原电势为-320mV)或烟酰胺腺嘌呤二核苷酸磷酸(NADPH,氧化还原电势-320mV),能够提供更高的能量驱动力。因此,将NAD(P)H替换为两种铁氧还蛋白作为电子供体,可以额外提供大约20kJ/mol的能量驱动力,从而增强反应的热力学可行性。同时,电子受体是CO2还是碳酸氢根也会影响微生物对碳的利用。CO2在与空气其他组分(1atm,1atm=101.325kPa,20℃)平衡时,其在水中(pH=7.4)的溶解浓度仅为0.012mmol/L,而CO2以碳酸氢盐的形式存在时,其在水中(pH=7.4,20℃)的溶解度为0.26mmol/L。因此,使用碳酸氢盐为碳源的反应比使用二氧化碳更加有效。
3.2
CO2自养微生物的工程化改造
3.2.1 食气梭菌
以食气梭菌为代表的产乙酸细菌(acetogens)属于常见的化能自养微生物,可以利用WLP固定CO2进行自养生长,在维持细胞生长的同时合成乙酸、乙醇、乳酸和2,3-丁二醇等。食气梭菌在利用CO2营自养生长时,需要H2或CO作为电子供体提供还原力,由于H2及CO在水中的溶解度极低(H2饱和浓度为7.1×10-4mol/L,37℃,100kPa;CO饱和浓度为8.2×10-4mol/L,37℃,100kPa),细胞在利用CO或H2受到气液间传质上的限制,从而限制梭菌的生长及产量。此外,食气梭菌在利用CO2产乙酸过程中容易受到电子匮乏等问题导致产率降低,产1mol乙酸仅能生产0.25~0.35mol ATP。Emerson等在永达尔梭菌利用CO2和H2作为碳源和能源时,额外添加硝酸盐作为电子受体,从而提高了细胞生长速率及ATP/ADP比值。为提高食气梭菌利用电子的效率,Haas等报道了一种气体扩散电极,可增强CO2与电极之间的相互作用,利用电解槽的电能协助梭菌发酵生产乙酸和乙醇。在提高细菌对气体组分摄取能力的同时,优化细菌培养基的组分能影响菌体的产率。Sun等在对拉格斯代尔梭菌(Clostridium ragsdalei)的连续发酵中发现,将培养基中的酵母提取物替换为棉花籽提取物时,可明显提高乙醇的产量。另外,pH与温度的改变都会影响食气梭菌产物的积累,通过优化菌株的生长条件与状况,可以实现产物的理性调控。Heffernan等研究表明,在CO2中添加少量CO共利用,使得产乙醇梭菌(Clostridium autoethanogenum)的固碳能力从460mmol CO2/(gDCW·d)提升至540mmol CO2/(gDCW·d),且固定的碳主要分布在乙醇中。
除了对发酵工艺的优化之外,通过代谢工程改造食气梭菌等产乙酸菌,以实现目标产物的理性合成,也成为目前研究的热点。Straub等在伍氏醋酸杆菌(Acetobacterium woodii)中表达了来自永达尔梭菌(Clostridium ljungdahlii)的磷酸转乙酰酶(phosphotransacetylase,PTA)及乙酸激酶(acetate kinase,ACK),从而使其在CO2发酵中乙酸产量提高到50g/L;在永达尔梭菌中,通过双敲除醇/醛脱氢酶后,乙酸的产率可达到原先的2.7倍;Cheng等在食一氧化碳梭菌(Clostridium carboxidivorans)过表达了醇/醛脱氢酶及fnr两个基因后,丁醇产量提高了22%。
食气梭菌展现了其在不同产物合成中的巨大潜力,Lanza Tech、Synata Bio和巨鹏生物等几家公司已经利用食气梭菌作为合成生物学平台,并实现部分产品的商业化生产。Lanza Tech使用改造后的C. autoethanogenum,通过吸收工业废气(含CO和CO2)生成乙醇和其他化学品,这种工艺已在钢铁厂实现应用,减少了CO2排放,并副产菌体蛋白。2024年11月,北京首钢朗泽科技股份有限公司(以下简称“首钢朗泽”)利用首钢京唐的焦炉煤气和转炉煤气(富含CO2)作为原料,通过气体预处理、发酵、蒸馏脱水等工艺流程,生产无水乙醇和新型饲料蛋白。该技术每生产1t乙醇可直接消耗约0.5t CO2,项目建成投产后预计每年可生产无水乙醇1.5×104t、蛋白饲料750t,预计年销售收入1.2亿元。类似地,Evonik与西门子合作开发的Rheticus项目结合了电解和发酵技术,利用特定菌株在发酵罐中转化CO2和H2,生产化学中间体丙酸和丁酸。Rheticus项目于2021年投产,年产能为2×104t,这些产品可进一步加工为多种精细化学品和生物材料。该领域方向具有较好的经济性和较低的碳排放,有望在生物基化工领域进一步扩展。
3.2.2 古菌
古菌的基因组结构不同于细菌和真核生物,因而传统的基因编辑技术(如CRISPR/Cas系统)在古菌中的应用相对受限。然而,科研人员逐步优化了CRISPR/Cas9和Cas12a等系统,以适用于古菌中的基因编辑。例如,已在产甲烷古菌(如Methanosarcina acetivorans)中成功应用CRISPR/Cas9系统调控关键代谢基因,实现了CO2的高效固定和甲烷生成。产甲烷古菌能够利用CO2和氢气生成甲烷,是碳捕集与利用的良好生物平台,工程化改造甲烷古菌,优化其WLP的关键酶系,有助于提升其CO2固定效率并提高甲烷产率。例如,通过调控甲基辅因子合成路径,Huber等在甲烷古菌中显著提高了甲烷产量。在工业化应用方面,这种利用CO2生成甲烷的途径已被逐步应用于废气的资源化处理,并开发出多个小规模工业化装置用于实验性生产。
此外,一些工程化改造研究专注于古菌对底物(如CO2、H2等)的利用效率,使其在高温和厌氧条件下生产乙醇、丙酸等有机物,开辟了将古菌用于多样化化学品生产的新途径。综上所述,古菌在极端条件下的代谢活性和工程化改造的可行性为第三代生物炼制提供了新的平台。未来,古菌的基因编辑和代谢优化工具将进一步完善,助力其在可持续燃料和化学品生产中的应用。
3.2.3 蓝细菌
蓝细菌又称蓝藻,是一种具光合自养能力的微生物,能够直接利用光能和CO2进行代谢。蓝细菌可以利用羧酶体增加胞内CO2浓度,进而提高CBB循环的固碳效率。作为重要的微生物细胞工厂,蓝细菌因其高效的CO2固定能力和丰富的代谢产物而备受关注。通过基因编辑技术,敲除竞争性代谢途径中的碳流分配关键酶,显著提升了蓝细菌的乙醇和异戊二烯产量。Lee等引入蜡酯合成酶,首次实现了蓝细菌异源合成脂肪酸乙酯。Lai等将梭菌的WL途径引入到蓝细菌中,实现了丁酸的高效合成。
除了直接改造目标产物途径,强化蓝细菌对光能的有效利用,增强CO2固定效率也是目前的研究热点。通过基因改造增强蓝细菌的光吸收系统和Rubisco酶活性,Li等有效提高了其CO2固定速率和碳流动性。将Rubisco酶的表达量增加并优化其催化活性,可以显著提高光合作用效率,增加碳源流向目标代谢产物。Nürnberg等确定了叶绿素f为远红外线生长情况下蓝细菌的光系统复合物。叶绿素f的发现有望拓宽蓝细菌对光能的利用。在耐受性上,丝氨酸羟甲基酶被认为与细胞耐盐性直接相关,这些抗逆性增强措施为蓝细菌在大规模生产中的应用铺平了道路,并有助于降低培养成本。
3.2.4 微藻
微藻作为同样具有光合自养能力的微生物,可以利用光合作用固定CO2的同时产生油脂等高附加值产品。相比于其他植物,微藻具有更高的光合效率,且对土地的占用远少于其他植物。据报道,生产1t微藻生物质的同时可以固定1.8t CO2。微藻包括小球藻(Chlorella)、螺旋藻(Spirulina)以及其他绿藻。微拟球藻(Nannochloropsis)等富油微藻的藻类脂质通过与甲醇之间的酯交换反应被转化为生物柴油。此类微藻脂质具有丰富的不饱和脂肪酸,其转化后的生物柴油适应于低温工作环境。2006年,美国Green Fuel Technology公司在亚利桑那州建立了偶联1040MW电厂烟气的碳捕捉系统,采用Green Fuel 3D Matrix技术利用烟气中的CO2大规模培育微藻,并将其转化为生物柴油。
近年来,合成生物学的发展拓宽了微藻产品的范围,其中多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)具有医疗、保健作用,成为目前利用微藻生物合成的热点领域之一。PUFAs中如前列腺素、白三烯等对维持人体免疫、心脑血管系统正常运作具有显著功效,但在人体合成速率极低,无法满足正常生理需求,因而需要在饮食或保健品中摄取。当前PUFAs主要来源为深海鱼类,然而过度捕捞及加工时大量的废弃物对生态环境造成严重破坏。相比于深海鱼类,微藻是天然的PUFAs生产者,具有持续生产微藻藻油的能力,且微藻藻油的不饱和脂肪酸纯度较高。Xin等通过对微球藻中2型二酰基甘油酰基转移酶的体外和体内活性进行系统分析,揭示了不同藻类生物合成的偏好性。通过合理调节共进化的2型二酰基甘油酰基转移酶转录水平,实现不同脂肪酸的理性合成。此外,利用合成生物学技术,微藻还可以用于疟疾疫苗等重组蛋白的生产。
3.3
异养微生物固定CO2工程化
3.3.1 优化能量供给增强CO2固定
异养微生物通常以葡萄糖等有机物为原料合成化学品,其发酵过程通常伴随着CO2的释放。然而,在异养微生物生产某些特定化学品的过程中,可以将释放的CO2进行重吸收并用于目标化学品的合成。例如,酿酒酵母以葡萄糖为底物生产乙醇时,产生CO2与NADH,多余的NADH可以用于CO2固定。基于此,Guadaluge-Medina等将蓝细菌的磷酸核糖激酶基因(prk)和编码Rubisco酶亚基的基因(rbcLXS)导入酿酒酵母中,在中心碳代谢途径中构建了可以固定CO2的卡尔文循环支路,并最终使得乙醇对底物的得率提高了10%。
为了使异养微生物能够固定更多的CO2,可以在生物体内引入外源的能量供给系统。目前,已证明在异养微生物体内有效的能量供给系统包括人工电子通道、氢气利用系统、视紫红质光系统以及半导体纳米捕光系统。目前与异养微生物CO2固定兼容性最好的能量捕获系统是半导体纳米捕光系统,例如,哈佛大学Joshi团队将半导体材料磷化铟颗粒组装到酿酒酵母细胞表面,酵母细胞利用表面的纳米颗粒获取光生电子,并将其用于NADPH的再生,高效合成莽草酸。近期,Hu等的一项研究报道了大肠杆菌组装硫化镉捕光系统,实现了光能驱动CO2的固定,工程菌株苹果酸与丁酸产量分别提高到1.48mol/mol葡萄糖和0.79mol/mol葡萄糖。
3.3.2 强化CO2羧化途径
羧化反应的通量是决定异养微生物固碳能力的重要因素。异养微生物具有各种羧化反应,典型的为PEP羧化反应和巴豆酰羧化反应。为进一步提高CO2固定效率以及目标化学品的生产产能,研究者通常会筛选效率更高的羧化酶在宿主细胞中过表达。例如,在大肠杆菌中过表达来自Mannheimia succiniciproducens的羧化酶,能够提高苹果酸合成能力,其生产速率达到0.77g/(L·h)。此外,优化菌体对CO2的利用也是提高CO2生物固定的有效手段。例如在大肠杆菌中过表达CO2转运蛋白(sbtA或bicA)与PEP羧化酶,菌株的琥珀酸产量增加了10%。强化羧化途径的另一个潜在策略是构建人工羧酶体。羧酶体是一类存在于蓝细菌和部分化能自养微生物的细菌微室,由紧密堆积的蛋白分子层构成,参与CO2固定。研究人员通过将源于硫氧化菌(Halothiobacillus neapolitanus)羧酶体编码基因簇hnCB引入大肠杆菌中,获得了功能性的多面体结构,含有该多面体的工程菌株具有更高的CO2固定效率。近期也有研究表明,将原绿球藻羧酶体编码基因groEL/S与分子伴侣在大肠杆菌中协同表达,能实现高效率的羧酶体自组装,并基于13C示踪实验,验证了羧酶体能够将CO2固定到中心代谢产物中。
3.3.3 引入异源CO2固定途径
通过将CO2固定途径引入异养微生物从而构建完整的CO2固定模块,其中包括3-HP循环和CBB循环等。2013年,Mattozzi等尝试在大肠杆菌中引入外源3-HP循环,并成功表达了3-HP循环中的关键酶丙二酰CoA还原酶(MCR)和丙酰CoA合成酶(PCS)。然而该途径在大肠杆菌中只有模块化作用,无法形成稳定且完整的通路。因此,研究人员尝试将CBB循环导入大肠杆菌,通过在大肠杆菌中表达磷酸核糖激酶(PRK)和RuBisCo,并结合羧酶体有效改善了大肠杆菌的CO2固定效率。后续通过实验室定向进化,将完整的CBB途径分为两个模块:TCA模块负责代谢丙酮酸提供ATP和NADH;CBB循环模块利用TCA的能量与NADH固定CO2并合成生长所需代谢物。通过13C示踪实验表明,细胞中糖类物质及氨基酸合成由CO2提供碳源,进而验证了工程菌株具备了功能齐全的CO2固定循环。该菌株被称为首个“半自养菌株”。基于此,后续研究实现了大肠杆菌利用甲酸提供的能量固定CO2。类似地,在毕赤酵母中构建CBB循环后,工程菌株实现了以CO2为碳源的自养生长。
04
结语与展望
以CO2为底物的第三代生物炼制技术,以其资源广泛性、环境友好性和产品多样性,为实现绿色制造和可持续发展提供了重要支撑。开发高效利用CO2的细胞工厂将实现社会的低碳可持续发展,从而带来更大的经济,社会和环境效益。尽管第三代生物炼制技术在生物制造方面展现出了巨大潜力,但同时也存在一些局限性和挑战。诸如CO2固定关键酶的催化效率低下,CO2固定涉及多个代谢步骤,细胞定向调控难度较大。部分自养微生物需要大量的能量与还原力固定CO2,对细胞正常生长造成负担。外源途径在宿主细胞内可能存在不兼容现象,从而对基因表达及其功能产生影响。在工业应用方面,绝大多数的固碳途径还是停留在“概念验证”阶段,技术指标未能达到规模化生物制造的需求。
因此,为了获取CO2高效利用的细胞工厂,还需进行许多工作。这其中包括:①合成生物学的深度应用,通过优化基因组编辑、代谢网络构建及人工细胞设计技术,能够精准调控微生物代谢流量,提升目标产物的产率和选择性;②通过生物与化学催化的协同作用,实现C1资源的高效转化,为工业化生产提供新路径;③结合代谢组学、蛋白组学等高通量技术结合机器学习算法,揭示微生物代谢机制,优化工程策略,提高生产效率;④针对不同C1资源特点,开发规模化、低成本的发酵工艺,推动技术在燃料、生物材料和医药等领域的应用落地;⑤政策支持和市场激励也是推动这一技术发展的重要因素。
第三代生物炼制有望在CO2资源循环利用、碳减排等方面发挥重要作用,为现代工业的绿色转型提供重要机遇,但其进一步发展仍需跨学科合作、技术创新和政策指导。未来,随着生物技术和工程技术的不断突破,第三代生物炼制将在能源、环境和材料领域释放更大的应用潜力,并为实现全球可持续发展目标提供有力支持。
▌ 参考信息:本文部分素材来自化工进展。由作者重新编写,系作者个人观点,本平台发布仅为了传达一种不同观点,不代表对该观点赞同或支持。如果有任何问题,请联系我们:15356747796(微信同号)。




